近日,史丽云教授团队在国际知名期刊Journal of Nanobiotechnology(中科院一区,IF 9.429)在线发表最新研究成果,报道了来自药用植物黄花蒿的纳米颗粒抗肿瘤作用其机制,论文题目为“Medicinal plant‑derived mtDNA via nanovesicles induces the cGAS‑STING pathway to remold tumor‑associated macrophages for tumor regression”。该研究首次报道来自黄花蒿的线粒体DNA (mtDNA)经纳米颗粒释放,激活小鼠肿瘤相关巨噬细胞中cGAS/STING信号通路而促进其向M1型巨噬细胞转化,从而有效抑制肿瘤细胞生长。
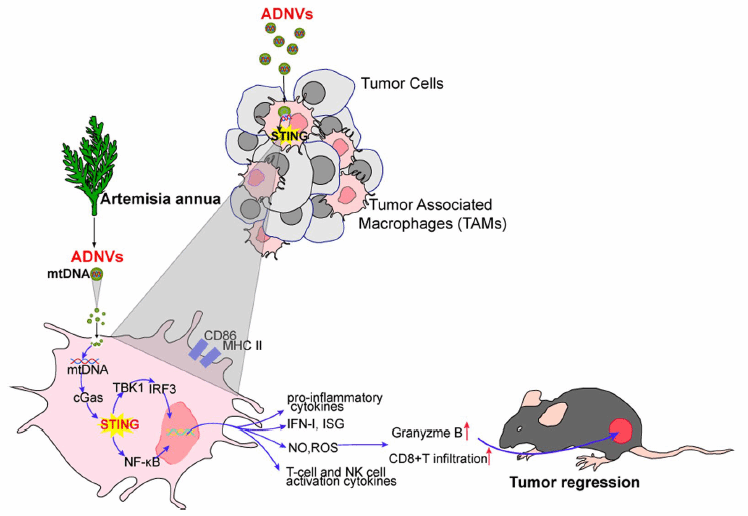
植物来源的囊泡被认为是物种间相互作用和相互交流的主要机制。药用植物黄花蒿是经典的用于抗疟治疗的药物,现有证据显示其具有更为广泛的生物活性,包括免疫调节和抗肿瘤特性,但其中作用方式和机制尚不清楚。课题组从植物黄花蒿中分离纯化了外泌体样颗粒,这些颗粒具有纳米级尺寸和双层膜结构,因此被称为黄花蒿来源的纳米囊泡(ADNVs)。研究发现,ADNVs可以通过重塑肿瘤微环境和重编程肿瘤相关巨噬细胞(TAMs),增强抗肿瘤免疫和抑制肿瘤生长。进一步研究表明,ADNVs中包裹的线粒体DNA (mtDNA),可通过囊泡内化到肿瘤相关巨噬细胞中,作为诱导cGAS-STING通路的主要效应分子,驱动巨噬细胞由“促肿瘤”向“抗肿瘤”表型转变,使处于免疫抑制状态的肿瘤微环境由冷“cold”向热“hot”转变,从而有效发挥抗偶肿瘤免疫作用。该研究的另一重要发现是,黄花蒿来源的纳米囊泡(ADNVs)协同免疫检查点抑制剂PD-L1单抗的联合治疗,抑制免疫治疗不敏感小鼠体内的肿瘤生长,延长荷瘤小鼠的生存期,显著改善免疫检查点阻断(immune checkpoint blockade,ICB)在肿瘤治疗中的疗效。
本研究首次报道了黄花蒿来源的纳米囊泡通过诱导免疫细胞中的免疫刺激信号,增强抗肿瘤免疫的作用,揭示了一种新的跨物种免疫激活和调控机制,为临床肿瘤免疫治疗提供了新思路。
该研究受国家自然科学基金项目(81991523、82270014、82200677)和国家重点研发项目(2018YFC1705900)等项目资助。
论文信息:Liu J1, Xiang J1, Jin C, Ye L, Wang L, Gao Y, Lv N, Zhang J, You F, Qiao H, Shi L. Medicinal plant-derived mtDNA via nanovesicles induces the cGAS-STING pathway to remold tumor-associated macrophages for tumor regression. J Nanobiotechnology. 2023;21(1):78. doi: 10.1186/s12951-023-01835-0.
论文链接:https://doi.org/10.1186/s12951-023-01835-0