2022年11月,我院耿石楠副研究员以第一作者身份在国际权威期刊Journal of Controlled Release(中科院1区,IF=11.467)上在线发表了题为NIR-triggered ligand-presenting nanocarriers for enhancing synergistic photothermal-chemotherapy的研究论文。
抗肿瘤纳米药物由于具有增强渗透与滞留(Enhanced Penetration and Retention, EPR)的独特药物动力学效应、可控释药和多模式协同等优点,在肿瘤治疗中表现出引人注目的疗效和安全性。特别是采用聚乙二醇(PEG)化的策略,已经成为抗肿瘤纳米药物延长体内循环时间,发挥EPR效应,增强靶向递送及提高肿瘤治疗效果的金标准。然而大量的研究表明,尽管PEG能提高纳米药物在肿瘤部位的蓄积,但其亲水性也阻碍了靶向配体与肿瘤细胞的特异性识别,极大地抑制了肿瘤细胞对纳米粒的摄取。即,所谓的“PEG困境(PEG dilemma)”。
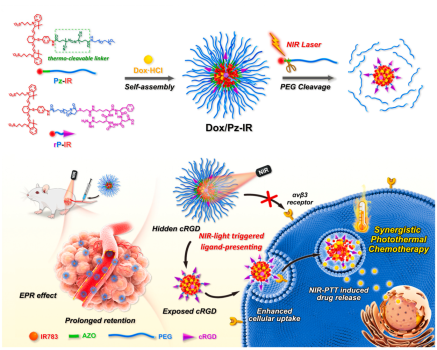
为了克服这一困境,此研究设计了一种光热诱导PEG分子链断裂,暴露靶标分子,从而增强肿瘤靶向递送效率的纳米载体,以具有可光热分解的偶氮类聚合物引发剂为连接分子,将长链PEG与光敏剂IR783偶联,同时在偶联IR783的短链PEG末端修饰cRGD靶向肽,利用IR783和抗肿瘤药物阿霉素(Dox)之间强烈的π-π堆积及疏水作用,将上述两种长链、短链PEG自组装形成载Dox的光热响应性PEG脱除的有机纳米载体(Dox@Pz-IR)。该纳米载体在血液循环过程中能够“隐藏”cRGD肽,避免与血清蛋白或正常组织细胞的非特异性结合,利用纳米药物的EPR效应,Dox@Pz-IR可蓄积到肿瘤部位,并在近红外光(NIR)照射下,通过IR783的光热效应诱导偶氮键断裂,脱除长链PEG,从而暴露出短链PEG末端修饰的cRGD肽,促进肿瘤细胞的摄取,解决“PEG困境”,增强其肿瘤靶向递送效率。与此同时,NIR光还诱导Dox@Pz-IR的脉冲释药,并实现光热-化疗的精准协同,为提高纳米药物靶向递送,增强肿瘤协同治疗提供了一种新策略。
本研究获得了国家基础研究计划项目(2020YFA0710700、2018YFA0208900)和国家自然科学基金项目(82172758、82203068、81873919)的资助。。
论文信息:Geng S, Guo M, Zhan G, Shi D, Shi L, Gan L, Zhao Y, Yang X. NIR-triggered ligand-presenting nanocarriers for enhancing synergistic photothermal-chemotherapy. J Control Release. 2022;353:229-240. doi: 10.1016/j.jconrel.2022.11.039.
论文链接:https://doi.org/10.1016/j.jconrel.2022.11.039